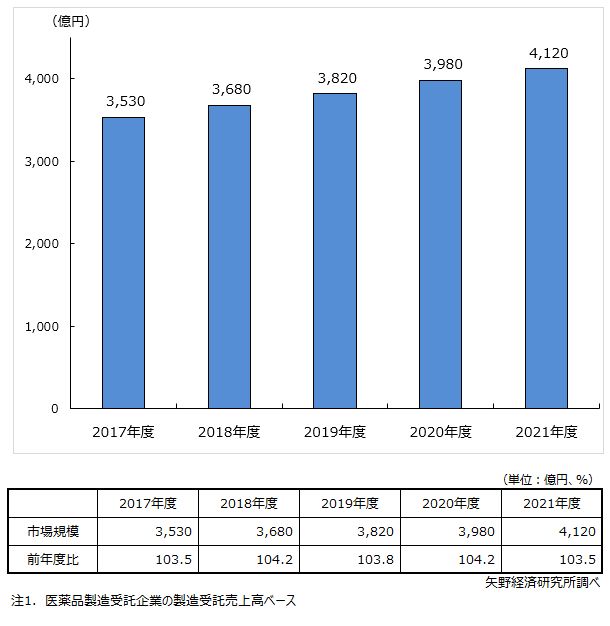
2021年度の医薬品製造受託市場は前年度比3.5%増の4,120億円と推計
~品質保証体制の構築が今後の大きな課題に~
1.調査結果概要
医薬品製造受託は2005年に改正薬事法が施行され、生産工場を持たなくとも製造販売業(元売業)の許可と製品の承認(製造販売承認)を得ることで販売できる仕組みとなり、製薬企業の製造部門の全面外部委託が可能となった。ジェネリック医薬品(後発医薬品)の普及に伴い、ジェネリック医薬品メーカーと製薬企業の提携など、ジェネリック医薬品の共同開発も拡大している。医薬品の外部製造委託は進展し、医薬品製造受託企業の受託件数、生産量は引き続き拡大傾向にある。
医薬品製造受託市場は、2017年度以降、3~4%程度の伸び率を継続している。2021年度の医薬品製造受託市場は、ジェネリック市場拡大に伴う共同開発による製造受託が伸長するとともに、薬価の下落で長期収載品の生産量が減少するなどの影響もあり、前年度比3.5%増の4,120億円と推計した。
2.注目トピック
品質保証体制の構築、品質管理体制の強化
改正薬事法の施行により、医薬品製造受託企業においても品質保証体制の強化が求められる事となったため、受託企業は品質保証体制の構築を図っている。
また、品質管理体制の強化も必要とされる。GMP(Good Manufacturing Practice)基準のクリアは勿論、法制度がグローバルスタンダードに沿ったものとなれば、さらに厳格なFDA(アメリカ食品医薬品局)レベルの品質管理体制や能力が求められる事は間違いなく、早急に品質管理能力を向上させることが必要である。
特に、受託企業各社が積極的な設備投資を行い、自動化製造システム導入により生産工程の自動化が進展すると、オペレーション自体が簡単となる。そうした状況においては、機械の性能(ハード)ではなく、臨機応変に対応できる人材(ソフト)をいかに育成し、確保するのかがポイントとなるため、人員を増やす企業が多い。
さらに、2021年8月に施行された改定GMP省令への対応も今後の重要なポイントとなっている。16年ぶりに大改訂されたこの省令では、実質的な国際基準であるPIC/S(医薬品査察協定及び医薬品査察共同スキーム)によるGMPガイドラインとの整合性をとることが求められており、自社品質管理体制を改めて見直す企業も多く見られている。
近年、医薬品製造の現場において安全性が疑問視されるような事故・事案が多発していることもあり、受託企業にとっては、管理出来た状態の確立とその維持を担保すべく、経営者や責任役員を含むGMP組織体制の整備と運用システムの構築をすることが、今後の医薬品製造受託市場における大きな課題となっている。
オリジナル情報が掲載された ショートレポート を1,000円でご利用いただけます!
【ショートレポートに掲載されているオリジナル情報】BCパターン
調査要綱
2.調査対象: 医薬品製造受託関連企業等
3.調査方法: 当社専門研究員による直接面談(オンライン含む)、ならびに文献調査併用
<医薬品製造受託市場とは>
本調査における医薬品製造受託とは、製薬企業が企画・開発(共同開発を含む)した医薬品の製造の全てまたは一部を受託している場合を製造受託と定義する。
また、製造受託については、純然たる外部企業からの製造受託と系列企業からの製造受託の2通りが考えられるが、本調査では系列企業からの製造受託を除外している。ただし、系列企業とは親会社の製品のみを製造している子会社とし、大手製薬企業の100%出資子会社でも、親会社以外の製造受託を実施している企業は、外部企業からの製造受託と定義して市場規模に含める。
なお、市場規模は、医薬品製造受託企業の製造受託売上高を合算し、算出した。
<市場に含まれる商品・サービス>
医薬品製造受託
出典資料について
お問い合わせ先
本資料における著作権やその他本資料にかかる一切の権利は、株式会社矢野経済研究所に帰属します。
報道目的以外での引用・転載については上記広報チームまでお問い合わせください。
利用目的によっては事前に文章内容を確認させていただく場合がございます。
